氢气使用方法中有一种是通过产氢气材料,目前认为能用于人体的安全材料主要包括镁、钙和硅。和钙镁不同,硅水反应产生氢气不会带来酸碱度改变,更重要的是硅在酸性和中心条件下稳定,只在碱性条件下才发生反应产生氢气。这些特点决定了硅材料的独特优势。本综述对硅产氢气发挥作用的研究进行了综述,作者认为硅产氢气是一种理想的生物抗氧化剂。抗氧化疗法是治疗氧化应激参与症状发作的疾病的有效方法。这种方法旨在当体内的抗氧化物质因过量氧化应激而耗尽时迅速补充它们。重要的是,补充抗氧化剂必须专门消除有害的活性氧(ROS),而不会与对身体很重要的生理上有益的ROS发生反应。在这方面,通常使用的抗氧化疗法可能是有效的,但由于缺乏特异性,也可能会引起不良反应。我们认为,硅基药物是划时代的药物,可以克服与当前抗氧化治疗相关的这些问题。这些药物通过在体内产生大量选择性抗氧化的氢气来缓解氧化应激相关疾病的症状。此外,硅基药物有望成为高效的治疗药物候选药物,因为它们具有抗炎、抗凋亡和抗氧化作用。在本综述中,我们讨论了硅基药物及其在抗氧化治疗中的潜在未来应用。已经有几篇关于硅纳米颗粒产生氢气的报道,但不幸的是,没有一个被批准为药剂。因此,我们认为,我们使用硅基药物对医疗应用的研究是该研究领域的突破。迄今为止从病理学动物模型获得的知识可能极大地有助于改进现有的治疗方法和开发新的治疗方法。我们希望这篇综述将进一步振兴抗氧化剂的研究领域,并导致硅基药物的商业化。全文内容约10000字,供有兴趣开展研发和学术研究的读者参考呼吸和免疫反应产生的活性氧(ROS)具有高度氧化性。在正常情况下,它们被体内抗氧化物质(超氧化物歧化酶、谷胱甘肽和过氧化氢酶)消除。然而,当ROS产生过多是由慢性疾病,病毒或细菌感染和暴食引起的时,体内的抗氧化机制不能充分消除ROS。因此,重要的细胞成分被ROS氧化,导致组织损伤和功能障碍。“氧化应激”是由体内过量产生的ROS和耗尽的抗氧化物质共同引起的病理状况[1,2,3]。氧化应激不仅参与各种疾病(如炎症、代谢、神经系统和缺血性疾病以及癌症)的发作和症状加重,还参与衰老[1,2,3]。因此,给予外源性抗氧化剂作为体内抗氧化剂的替代品是有用的[4]。不幸的是,许多抗氧化剂(如维生素C(VC)、维生素E(VE)、多酚和胡萝卜素——可能会产生不良反应,因为它们还可以去除参与正常生理活动的有用的生物ROS(超氧化物、过氧化氢等)[5,6,7,8,9,10]。例如,过量的VC和VE会引起恶心、呕吐和癌症风险增加[11,12,13]。此外,当动物实验中确定的VC和VE的有效剂量转换为人类当量时,产生的剂量远高于国家学术医学食品和营养委员会推荐的VC(2g/d)或VE(1g/d)的可耐受上限[14]。矛盾的是,过量的维生素C起到助氧化剂的作用,会使症状恶化[15]。因此,即使通过基础研究获得了有希望的结果,抗氧化疗法的临床应用也存在挑战。鉴于上述信息,2007年氢作为抗氧化剂的发现非常重要[16]。氢选择性地消除羟基自由基等有害ROS,已知可有效缓解各种疾病的病理[17,18]。此外,氢抗氧化疗法没有副作用的报道是安全的[19]。然而,体内给药方法可以改进。目前,主要有两种方法:氢气吸入和饮用水。前者由于存在爆炸风险而仅限于特定设置,而在后者中,只有少量的氢气可以溶解在水中(1.6 ppm),由于其出色的透氢性,无法长时间维持升高的氢浓度。相比之下,我们的硅基药物与水反应生成氢气,通过口服含氢剂的饮食,可以向啮齿动物肠道填充大量氢气(图1)[20,21]。到目前为止,硅基药物已经缓解了ROS介导的疾病的病理,例如UC结肠炎(UC)、帕金森病、肾衰竭和面瘫[21,22,23]。我们相信,硅基药物为氢抗氧化治疗中的上述挑战提供了有效的解决方案。以前的报告已经证明了硅基药物对每种疾病的疗效。然而,目前还没有报道研究抗氧化作用的详细作用机制及其在硅基药物中的各种性质。在这篇综述中,超越每篇论文框架的横断面分析揭示了一个有趣的假设,即硅基药物具有多种作用,并且这些作用通过循环系统在各种器官中发挥。我们详细描述了基于Si的药物的特征和疗效,并讨论了基于SI的药物在治疗ROS介导的疾病中的潜力及其假设的作用机制。我们的硅基药物由多晶硅粉制成(大阪钛技术株式会社,日本大阪;Si 5N 粉末 2–45 μm)。在乙醇中对Si粉末进行珠磨后,使用过氧化氢溶液进行表面处理以提高表面反应性。为了提高硅基药物的安全性,进行了团聚处理。平均微晶尺寸为20-30 nm。图1显示了硅基药物的扫描电子显微照片。可以清楚地看到,硅基药物由Si纳米粉末的附聚物组成。附聚物的尺寸为0.1-20μm。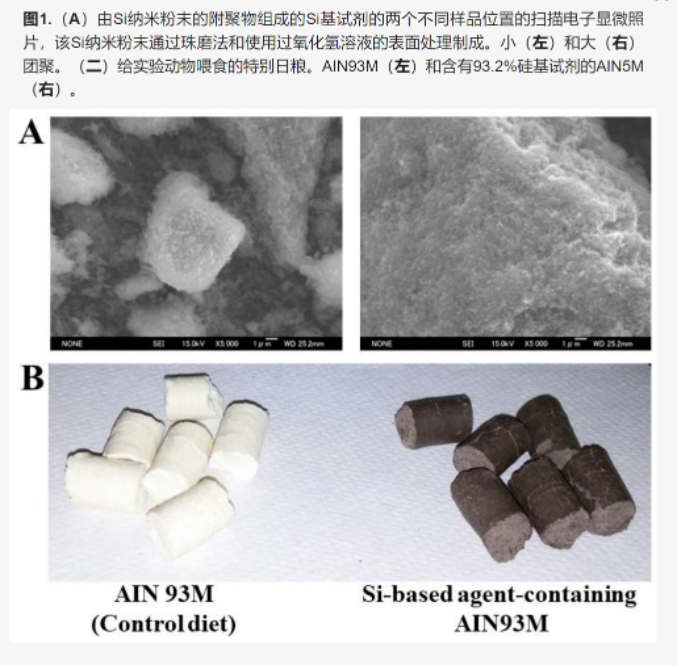
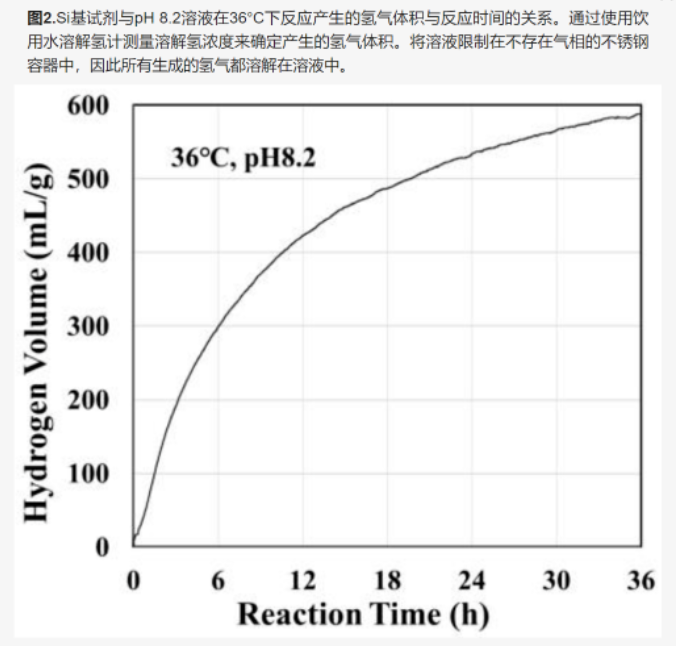
图2显示了硅基药物与pH 8.2水溶液在36°C下反应产生的氢气体积[20,21]。该制氢反应持续超过24小时。已经观察到,氢气生成速率随着反应溶液的pH值而显着增加,而反应溶液本身的pH保持不变[20]。从这些实验结果中,我们推导出了以下制氢反应公式:Si + 2OH− → SiO2 + 2H (or H2) + 2e2H2O + 2e → 2OH− + 2H (or H2)Si + 2H2O → SiO2 + 4H (or 2H2)由于反应(1)的速率远低于反应(2)的速率,因此整体产氢反应(反应(3))速率由反应(1)决定:在反应(1)中,OH−离子与Si反应,因此,反应速率随着OH浓度的增加而大大增加−离子,即 pH 值。此外,在反应(1)中,OH离子被消耗,而在反应(2)中,它们以等量产生,因此,在整个反应(3)之后,所得溶液的pH值保持不变。-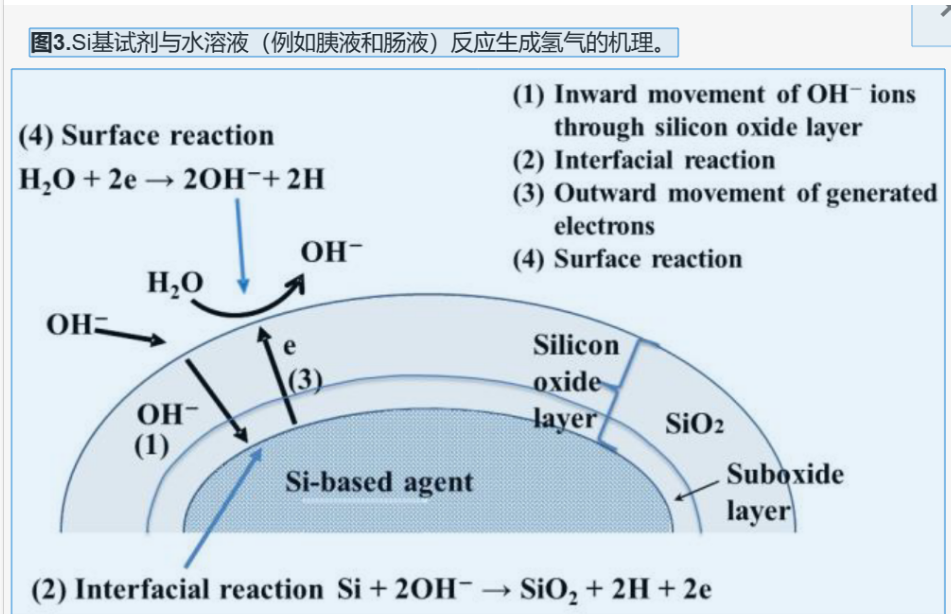
图3显示了使用硅基药物产生氢气的机理。在反应之前,硅基药物被1-2nm厚的氧化硅层覆盖,并且随着制氢反应的进行,该厚度增加(参见反应(3))[24]。在第一个反应步骤中,OH离子通过氧化硅层向内移动。氧化硅层表面吸附的OH离子引起的电场增强了OH离子的向内运动[20]。在第二步中,当OH离子到达硅基药物/氧化硅界面时,界面反应(3)继续进行。界面反应涉及四个基本反应[25]。2SiO + OH− → Si2O3 + H + eSi2O3 + OH− → SiO2 + H + e反应(4)-(7)产生的电子向外移动并被困在表面状态(即表面带隙中的特征能级)。然后,水分子接受这些电子,导致OH−离子和氢。因此,在界面区域和表面产生氢气。我们观察到氢原子与表面结合,并在制氢反应后存在界面Si原子。这些氢原子极有可能是硅基药物高还原力的来源。在动物实验中,我们观察到活性硫物种的浓度随着硅基药物的施用而增加,并且认为硅基药物上的氢原子在其形成中起着重要作用。如上一节所述,硅基药物与水反应生成氢气[20]。氢是一种抗氧化剂,专门清除羟基自由基等有害的 ROS。很明显,使用氢气的抗氧化治疗可以缓解许多疾病的病理,例如脑缺血再灌注(IR)损伤、帕金森病和肝炎[17,18]。由于到目前为止没有氢气副作用的报道[19],氢有望成为一种极好的抗氧化治疗剂。我们的硅基药物的抗氧化作用是由试剂表面产生的氢引起的。由于硅基药物的制氢反应发生在中性至碱性条件下,因此制氢部位的活性受肠道pH值的影响。我们设计的测量小鼠肠道pH值的方法[26]表明,回肠(pH 7.3)至直肠(pH 7.8)呈碱性,盲肠在pH 8.4时碱性最强[21]。令人惊讶的是,硅基药物使肠道比正常状态下略呈碱性,促进了氢气的产生。口服硅基药物在小鼠肠道中产生氢气[21]。此外,胃、大肠和小肠中的氢量增加。当然,胃是酸性的(pH 3.7),体外实验结果表明,硅基药物在酸性条件下不产生氢气。因此,无法想象胃中会产生氢气。由于其优异的渗透性,氢被认为很容易从生成部位扩散出肠道[27]。然而,由于硅基药物产生的氢量可能已超过扩散到体外的量,因此生成的部分氢可能已通过肠道到达胃。此外,硅基药物在体外产生了大量的氢气[20];然而,将硅基药物施用到小鼠肠道后,氢气生成的增加率不是很高[21]。由于肠道的容量是固定的,因此可以想象氢气由于其渗透性而释放到体外。换句话说,在硅基剂给药的小鼠中,肠道可能已被氢饱和。不仅可以通过不断将抗氧化剂从胃输送到大肠来应对各种病理状况,而且这一过程还参与氢等自主神经的调节[28]。据报道,UC患者的VC和VE均被耗尽[29,30],UC小鼠模型中内源性氢耗尽[21]。这些发现表明,UC的发作会导致过度的氧化应激,并且氢作为抗氧化剂被消耗和耗尽以缓解氧化应激。四氯化碳诱导的肝炎小鼠模型肝脏中氢的消耗表明,当发生氧化应激时,氢与其他抗氧化剂一样被用作抗氧化剂[21]。受影响区域的氧化应激增加,这需要消除许多抗氧化剂。硅基药物的施用通过补充受影响区域(如大肠和肝脏)中耗尽的氢来缓解疾病状况的恶化。因此,硅基药物有望构成针对此类疾病的出色抗氧化治疗。脂质过氧化物也会氧化其他物质,多不饱和脂肪酸尤其会引起铁死亡,这是铁依赖性细胞死亡[31]。抑制脂质过氧化物的产生和增加对于控制氧化应激和细胞死亡是必要的。根据以前的报道,氢倾向于积聚在细胞膜的脂质双层中[32]。氢比在水中更丰富且可溶于不饱和脂肪酸(如辛酸和亚麻酸)。钙内流在细胞膜含有溶解氢的细胞中受到抑制。由于钙是细胞信号转导中的第二信使[33],因此氢有可能通过钙信号传导调节生物学功能并发挥抗氧化作用。由于脂质过氧化物是氢的靶标之一,硅基药物也可能在减轻脂质氧化方面发挥重要作用。硅基药物可缓解各种疾病中脂质过氧化物的积累。基于血液中脂质氧化的氧化应激分析显示,硅基药物可缓解UC、慢性肾衰竭、面瘫和间质性肺炎小鼠模型中与病理状况相关的全身氧化应激[21,22,23,34]。特别是,我们研究了UC小鼠模型中过氧化脂产生的抑制作用。硅基药物可抑制血液中早期产物(己酰赖氨酸)和脂质过氧化物的增加,并增加结肠中4-羟基-2-壬烯醛(脂质过氧化物产生链反应的指标)[21]。此外,硅基药物可抑制丙二醛(脂质过氧化的最终产物)在慢性肾功能衰竭、肾缺血再灌注(IR)损伤和皮瓣移植过程中的IR损伤中的增加。因此,已经证明硅基药物在脂质氧化的各个阶段起作用。由于硅基药物可抑制肾脏疾病中尿液8-羟基-2-脱氧鸟苷的增加[22,35,36,37],这些结果表明硅基药物可消除各种氧化代谢物,尤其是脂质过氧化物。硅基药物也会影响Nrf2-Keap1系统,这是一种体内抗氧化机制[38]。在非氧化应激下,Nrf2保留在细胞质中,在那里它与Keap1结合并经历蛋白酶体依赖性蛋白水解抑制。当细胞暴露于氧化应激或亲电试剂时,Nrf2和Keap1之间的结合被破坏,Nrf2被转移到细胞核,在那里它诱导抗氧化基因的表达,如Hmo-1和胱硫硫氨酸γ裂解酶(Cth)[38]。在慢性肾功能衰竭小鼠模型的肾脏和LPS诱导的母婴感染小鼠的胎盘中观察到氧化应激增加和内源性抗氧化因子减少;然而,硅基药物抑制了这些因素的减少并减轻了氧化应激[35,39]。SIRT1是一种组蛋白脱乙酰酶,可激活Nrf2[40]。尽管SIRT1表达在肾衰竭小鼠模型中有所降低,但施用硅基药物可缓解这种降低[35]。这些发现表明,硅基药物直接激活Nrf2-Keap1抗氧化系统。硫代谢物(例如硫化氢和谷胱甘肽)显著影响生物体的氧化还原状态[41]。根据详尽分析硫代谢化合物的硫指数分析,UC小鼠模型的大肠被氧化,而当给予相同的小鼠硅基药物时,它们的大肠处于还原状态。因此,根据基于硫代谢物的氧化还原指数,硅基药物可减轻与UC相关的氧化[21]。这表明硅基药物对涉及硫代谢物的体内氧化还原系统具有积极影响。特别是,在用硅基药物处理的UC小鼠模型中,强活性硫物种(RSS)如谷胱甘肽多硫化物的增加参与抑制大肠中的炎症相关氧化。RSS以过硫化半胱氨酸(一种将过量硫原子添加到半胱氨酸的硫醇(SH)基团的分子)为代表,是一种生物活性物质,具有很强的抗氧化和抗炎作用,并具有调节氧化还原信号的能力[42,43,44,45,46]。特别是,硅基药物会增加谷胱甘肽多硫化物的水平。谷胱甘肽和谷胱甘肽过氧化物酶将脂质过氧化物降解为无害的脂醇[47,48]。因此,硅基药物可以通过谷胱甘肽/谷胱甘肽过氧化物酶系统解毒脂质过氧化物。在受感染的小鼠胎盘中,硅基药物也增加了半胱氨酸合成酶Cth的表达,表明不仅可以激活RSS,还可以激活整个硫代谢途径[21,39]。此外,IR损伤肾脏的RNA测序显示,施用硅基药物后,氧化应激相关因子的表达降低[37]。事实上,硅基药物可抑制与IR相关的过氧化氢酶水平的降低,IR是一种中和过氧化氢的抗氧化酶[49]。综上所述,这些结果表明,硅基药物影响NRF2-Keap1和涉及RSS的谷胱甘肽/谷胱甘肽过氧化物酶系统,激活体内抗氧化机制。总之,硅基药物通过激活体内氢的抗氧化作用和抗氧化机制来消除氧化应激,从而减轻症状(表1)。抗氧化疗法是治疗与氧化应激相关的疾病的有效策略。然而,它们的功效受到所需量耗尽的抗氧化剂补充的速度的影响。此外,必须开发专门中和有害ROS的适当抗氧化剂。人们认为纳米抗氧化疗法可以解决这些挑战。目前,存在使用铂纳米颗粒[51],GSH转运纳米脂质体[52]和高分子量聚合物[53]的方法。这些方法可用于增强抗氧化剂的能力和特异性。硅基药物也可以被认为是携带氢的纳米器件,氢是一种高度特异性的抗氧化剂。具有纳米级颗粒的硅基药物已被证明比由较大颗粒组成的试剂更有效[37]。这是因为水与试剂表面的硅反应生成氢气[22],从而减小了硅基药物的尺寸,增加了表面积,并产生了更多的氢。因此,近年来其效力有所提高。因此,我们认为纳米抗氧化疗法是一种创新方法,可以克服限制现有抗氧化疗法的问题。纳米疗法也被用作抗癌治疗,并有可能显着改善许多疾病的治疗。未来,硅基药物将有助于纳米治疗方法的发展。已经确定,硅基药物除了具有抗氧化作用外,还具有抗炎作用。Si 基药物抑制炎症期间观察到的促炎细胞因子(白细胞介素 (IL)-6、IL-1β、肿瘤坏死因子-α (TNF-α)、干扰素 (IFN)-γ 和 IFN-α)、趋化因子(C-C 基序趋化因子配体 2:CCL2)和促炎因子(诱导性一氧化氮合酶:iNOS)的增加。特别是,在许多与炎症相关的疾病中,硅基药物抑制与病理状况相关的IL-6表达增加,例如肾衰竭、肾IR损伤、皮瓣移植期间的IR损伤、UC、母婴感染和神经性疼痛[21,22,37,39,50,54,55].由于IL-6促进各器官的急性期炎症,因此抑制IL-6表达有助于缓解病理状况[56]。此外,肾IR损伤大鼠模型肾脏的RNA测序表明,用硅基药物治疗倾向于抑制免疫反应和细胞因子产生的信号通路。事实上,硅基药物的给药抑制了促炎因子(细胞间粘附分子1:ICAM1;佛波醇-12-肉豆蔻酸-13-乙酸酯诱导蛋白1:PMAIP1)和过氧化物酶体增殖物激活受体α(PPARα)降低(PPARα)(一种抗炎因子[37]。因此,通过调节由病理状况引起的炎症相关因素的变化,硅基药物倾向于缓解炎症。巨噬细胞和中性粒细胞浸润受累结肠、胎盘和肺分别在UC、母婴感染、神经性疼痛和肠肺炎小鼠模型中受到抑制,从而缓解结肠萎缩,降低流产发生率,改善三叉神经节脱髓鞘和抑制肺间质纤维化[21,34,39,[55]特别是在神经性疼痛大鼠中,硅基药物通过NLR家族和含pyrin结构域的1蛋白(NLRP3)炎症小体抑制炎症Capsae-3的活化,从而抑制小胶质细胞焦亡,从而导致炎症的激活[55]。有趣的是,磁共振成像和磁共振血管造影等影像学分析显示,UC患者的结肠炎症和相应的相关血管舒张受到抑制[21]。我们成功地实时捕获了基于Si的试剂介导的活小鼠炎症抑制,这是相当有价值的。在另一项研究中,在母婴感染研究中,小鼠大脑中的poly(I:C)诱导了炎症;然而,没有发生氧化应激[54]。综上所述,这些结果表明硅基药物直接抑制炎症(表2)。硅基药物的抗炎作用是什么原因?一种假设是这些效应是氢介导的。氢通过抑制促炎细胞因子来抑制炎症[17,18]。相反,已经发现RSS也负调节由Toll样受体介导的促炎作用,从而保护细胞免受炎症[57]。这两个因素都可能导致观察到的抗炎和抗氧化作用。综上所述,这些结果表明硅基药物不仅具有抗氧化作用,还具有抗炎作用。细胞凋亡诱导的成分细胞丢失导致器官功能障碍,导致疾病的发作和加重。因此,抑制细胞凋亡对疾病治疗非常有效。在肾衰竭大鼠模型中,施用硅基药物可抑制半胱天冬酶3,即最终的细胞凋亡执行因子[22,34]。在肾IR损伤大鼠模型中,与未治疗组相比,硅基制剂治疗组观察到凋亡信号系统的下调[37]。事实上,硅基药物可缓解肾IR损伤、肾衰竭中的细胞死亡以及睾丸静脉曲张中精子DNA的片段化[22,35,36,37]。此外,硅基药物可抑制皮瓣移植过程中IR损伤引起的细胞死亡,从而减少皮瓣坏死面积并减轻皮瓣损伤[50]。此外,在帕金森病小鼠模型中,硅基药物抑制了6-羟基多巴胺诱导的黑质多巴胺神经元细胞死亡,并缓解了运动协调性恶化[22]。有趣的是,使用硅基药物会增加胎盘中重要的抗凋亡因子Pstg2的表达,并显著缓解母婴感染引起的胎盘结构塌陷[39]。特别是,在施用硅基药物后观察到Pstg2表达高于正常状态的增加。综上所述,很明显,硅基药物除了具有抗氧化活性外,还具有抗凋亡作用(表3)。慢性肾衰竭中观察到的肾纤维化是一种主要涉及肾小管萎缩和间质纤维化的组织改变,可促进进展至终末期肾衰竭[58]。因此,减少肾纤维化是治疗慢性肾功能衰竭的一种有前途的治疗策略。硅基药物抑制了肾衰竭大鼠模型中前纤维化因子(例如金属蛋白酶-1(TIMP1)和α-平滑肌肌动蛋白(α-SMA))等促纤维化因子的表达增加。虽然肾纤维化会降低肾功能,但硅基药物可缓解肾小球肥大和蛋白尿,并导致功能下降时观察到的血肌酐升高,这与肾衰竭的进展有关[22,35]。在肾衰竭大鼠模型中,IL-6表达增加,并通过增加胶原表达促进纤维化[22,35];然而,有人认为,硅基药物可以通过抑制纤维化的表达来缓解纤维化[22]。此外,在间质性肺炎小鼠模型中,硅基药物通过抑制与病理相关的α-SMA表达增加来显着缓解肺纤维化[34]。总的来说,这些结果表明,硅基药物可抑制间质纤维化(表3)。硅基药物的主要作用是它们的抗氧化作用,但迄今为止在使用疾病小鼠模型的各种研究中获得的结果表明,硅基制剂可能具有其他作用。事实上,在由免疫反应引起的炎症期间,免疫细胞释放的ROS增强了氧化应激;因此,炎症和氧化应激密切相关[59]。因此,氧化应激的减少导致炎症作用的抑制。此外,由于氧化应激引起的损伤会诱导细胞凋亡,因此仅减轻氧化应激会抑制细胞凋亡[60]。然而,在母婴感染小鼠模型中观察到的抗炎作用与氧化应激没有直接关系 - 以及正常状态下胎盘中抗凋亡因子Ptgs2的高表达 - 表明硅基药物具有直接的抗炎和抗凋亡作用。相比之下,与慢性炎症相关的巨噬细胞浸润和氧化应激增加与纤维化显着相关。因此,硅基药物的抗纤维化作用可能是其抗氧化和抗炎作用的结果[61]。无论如何,由于通过两种作用(抗氧化和抗炎)强烈抑制纤维化可缓解病理状况,因此硅基药物作为纤维化疗法具有巨大潜力。





